- Pracowałem z najlepszymi. Możesz mi zaufać.
- 790-768-482
- info@rafalszrajnert.pl
Norma ISO 17025:2018-2 (PN-EN ISO/IEC) omówienie SZKOLENIE
![Rozwój osobisty i piramida Maslowa - hierarchia ludzkich potrzeb, samorealizacja [definicja, przykłady] 2 Rozwój osobisty i piramida potrzeb Maslowa](https://www.rafalszrajnert.pl/wp-content/uploads/2017/11/rozwoj_osobisty-80x80.jpg)
Rozwój osobisty i piramida Maslowa – hierarchia ludzkich potrzeb, samorealizacja [definicja, przykłady]
3 kwietnia, 2024![Jak prowadzić zdrowy tryb życia [12 zasad zdrowego stylu] 3 Zdrowy tryb życia](https://www.rafalszrajnert.pl/wp-content/uploads/2018/09/zdrowy_tryb_zycia-80x80.jpg)
Jak prowadzić zdrowy tryb życia [12 zasad zdrowego stylu]
5 kwietnia, 2024Norma ISO 17025:2018-2 (PN-EN ISO/IEC) omówienie SZKOLENIE


REKLAMA
Koniecznie zobacz NAJLEPSZE szkolenie z Facebooka na rynku

Link do kursu: szkolenie Facebook Ads
Szkolenie ISO 17025, szkolenie dla laboratoriów i szkolenie na auditora wewnętrznego ISO 17025:2017
Zamów poniżej dla siebie, swojego laboratorium lub pracowników
+48 790-768-482
info@rafalszrajnert.pl
Zawartość strony
- 1 Wprowadzenie do ISO 17025 (polska wersja)
- 2 Dołącz do nas NA DARMOWYM WIDEO
- 3 Ogólne wymagania dotyczące kompetencji laboratoriów badawczych i wzorcujących
- 4 Wymagania ogólne
- 5 Wymagania dotyczące struktury
- 6 Wymagania dotyczące zasobów
- 7 Wymagania dotyczące procesu
- 7.1 Przegląd zapytań, ofert i umów
- 7.2 Wybór, weryfikacja i walidacja metod
- 7.3 Pobieranie próbek
- 7.4 Postępowanie z obiektami do badań lub wzorcowań
- 7.5 Zapisy techniczne
- 7.6 Ocena niepewności pomiaru
- 7.7 Potwierdzenie ważności wyników
- 7.8 Raportowanie wyników
- 7.8.1 Wspólne wymagania dotyczące raportów (sprawozdań z badań, świadectw wzorcowania lub sprawozdań z pobierania próbek)
- 7.8.2 Wymagania szczególne dotyczące sprawozdań z badań
- 7.8.3 Wymagania szczególne dotyczące świadectw wzorcowania
- 7.8.4 Raportowanie pobierania próbek – wymagania szczególne
- 7.8.5 Przedstawianie stwierdzeń zgodności
- 7.8.6 Przedstawianie opinii i interpretacji
- 7.8.7 Zmiany do raportów
- 7.9 Skargi
- 7.10 Prace niezgodne z wymaganiami
- 7.11 Nadzorowanie danych i zarządzanie informacją
- 8 Wymagania dotyczące systemu zarządzania
- 8.1 Postanowienia ogólne i możliwe opcje
- 8.2 Dokumentacja systemu zarządzania -Opcja A
- 8.3 Nadzór nad dokumentami systemu zarządzania (Opcja A)
- 8.4 Nadzór nad zapisami (Opcja A)
- 8.5 Działania odnoszące się do ryzyk i szans (Opcja A)
- 8.6 Doskonalenie (Opcja A)
- 8.7 Działania korygujące (Opcja A)
- 8.8 Audity wewnętrzne (Opcja A)
- 8.9 Przeglądy zarządzania (Opcja A)
- 9 Spójność pomiarowa- rozwinięcie
- 10 Opcje systemu zarządzania- rozwinięcie
- 11 Jakie dokumenty i zapisy są wymagane?
- 12 W jaki sposób norma ISO 17025 wpływa na międzynarodowe uznawanie wyników badań i wzorcowań przeprowadzanych przez laboratoria?
- 13 Jakie są główne wyzwania związane z wdrożeniem i utrzymaniem zgodności z normą ISO 17025 w laboratorium?
- 14 Czy norma ISO 17025 odnosi się wyłącznie do laboratoriów naukowych, czy może być stosowana również w innych typach laboratoriów, np. w przemyśle?
- 15 Powszechnie używane nieobowiązkowe dokumenty
Wprowadzenie do ISO 17025 (polska wersja)
MEGA SKUTECZNY KURS, dzięki któremu nauczysz się pisać reklamy i zwiększysz zyski.
Kliknij w obrazek poniżej:

Norma ISO/IEC 17025 została opublikowana przez ISO w roku 1999. Była wynikiem współpracy pomiędzy Międzynarodową Komisją Elektrotechniczną i ISO. Norma ISO 17025 zastąpiła wytyczne ISO 25 i EN 45001.
Celem przewodnim standardu normy ISO 17025 było stworzenie dla laboratoriów badawczych i wzorcujących wytycznych odnoszących się zarówno zarządzania jakością, jak i wymagań technicznych, co do ich prawidłowego funkcjonowania. Norma została zaktualizowana po raz ostatni w listopadzie 2017 roku (polskie wydanie 2018-02). Struktura trzeciego wydania normy ISO/IEC 17025 utożsamia się z pozostałymi normami z serii 17000 wydanych przez CASCO, z kolei wiele nowych definicji zamieszczonych w normie, zostało uwspólnionych z ISO 9001
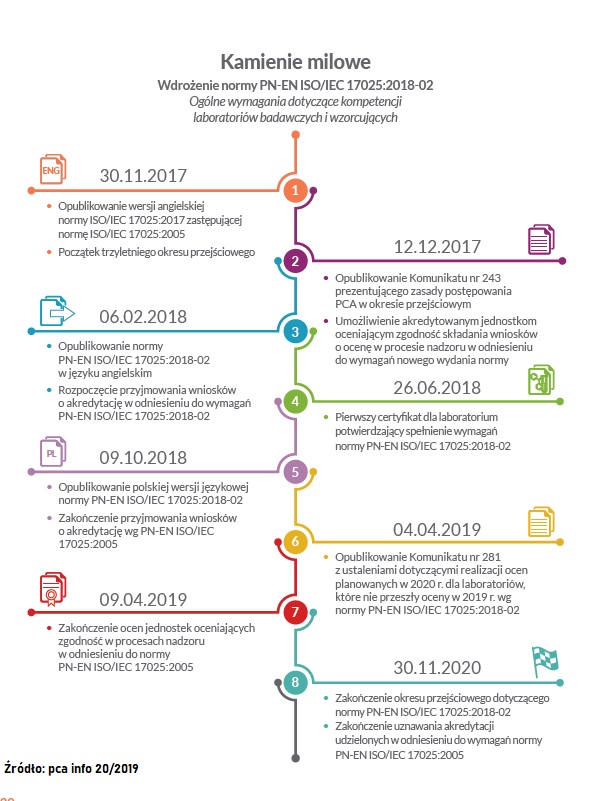
Już czytając tytuł normy PN-EN ISO/IEC 17025:2017 (PN-EN ISO/IEC 17025:2018-2) „Ogólne wymagania dotyczące kompetencji laboratoriów badawczych i wzorcujących” trzeba od razu wyjaśnić różnice pomiędzy laboratorium badawczym i wzorcującym.
Zaufali mi najlepsi:

Dołącz do nas NA DARMOWYM WIDEO
Wpisz Swój Najlepszy Adres Email, Ponieważ Na Niego Dostaniesz Link.
Podział ten związany jest z działalnością prowadzoną przez laboratorium. Badawcze może ono zajmować się badaniem (np. w dziedzinie ochrony środowiska, geologii, korozji, mikrobiologii, radiacji itp.) lub wzorcowaniem( np. w dziedzinie ustalania wag, masy, objętości, wilgotność itp.).
Definicje obu procesów przedstawiam poniżej.
BADANIE – Działanie techniczne, które polega na określeniu, zgodnie z ustaloną procedurą, jednej lub wielu właściwości albo możliwości danego wyrobu, materiału, sprzętu, organizmu, zjawiska fizycznego, procesu lub usługi.
WZORCOWANIE – Zbiór operacji, ustalający, w określonych warunkach, relacje między wartościami wskazanymi przez przyrząd pomiarowymi lub układ pomiarowy, albo wartościami reprezentowanymi przez wzorzec miary lub materiał odniesienia, a odpowiadającymi im wartościami wielkości, realizowanymi przez wzorzec odniesienia wraz z podaniem niepewności tego pomiaru.
Ogólne wymagania dotyczące kompetencji laboratoriów badawczych i wzorcujących
Wymagania w sferze zarządzania dotyczą:
- Uregulowania funkcjonowania całego laboratorium,
- Zarządzania (polityka, komunikacja wewnątrz laboratorium,
- Doskonalenia (zaangażowanie najwyższego kierownictwa),
- Dokumentacji i zapisów,
- Podwykonawstwa badań,
- Zakupów,
- Obsługi klientów (łącznie ze skargami),
- Nadzoru nad niezgodnymi badaniami i/lub wzorcowniami,
- Działań korygujących i zapobiegawczych,
- Auditów i przeglądów zarządzania.
Wymagania techniczne dotyczą:
- Personelu,
- Warunków lokalowych i środowiskowych,
- Metod badań i/lub wzorcowań wraz z ich walidacją, szacowaniem niepewności,
- Nadzorowania wyposażenia,
- Zapewnienia spójności pomiarowej,
- Pobierania próbek i postępowanie z obiektami do badań,
- Zapewnienia jakości badań i/lub wzorcowań,
- Przedstawiania wyników badań i/lub wzorcowań.
Zakres normy
Norma PN-EN ISO IEC 17025:2018-2 określa ogólne wymagania, które dotyczą:
- kompetencji,
- bezstronności,
- spójnego działania laboratoriów
Norma ISO 17025 ma zastosowanie do wszystkich organizacji, które prowadzą działalność laboratoryjną, bez względu na liczbę osób zatrudnionych.
Normę ISO stosuje się w celu potwierdzenia, lub uznania kompetencji laboratoriów.
Definicje użyte w normie ISO 17025
Bezstronność– zachowanie obiektywności, czyli brak konfliktów interesów (neutralność), lub rozwiązanie ich aby nie miały niekorzystnego wpływu na działanie laboratorium
Skarga – możliwość wyrażenia niezadowolenia w stosunku do laboratorium
Porównania międzylaboratoryjne – zorganizowanie, ocena i porównanie pomiarów/badań przez minimum 2 laboratoria
Porównania wewnątrzlaboratoryjne – zorganizowanie, wykonanie i ocena pomiarów/badań w tym samym laboratorium. Dotyczy tych samych lub podobnych obiektów
Badanie biegłości – ocena rezultatów uczestnika za pomocą porównań międzylaboratoryjnych
Laboratorium – jednostka realizująca badanie, wzorcowanie lub pobieranie próbek, które są podawane badaniom i wzorcowaniom
Zasada podejmowania decyzji – opisuje w jaki sposób niepewność pomiaru jest brana pod uwagę przy określaniu zgodności
Weryfikacja – potwierdzenie za pomocą obiektywnego dowodu, że przedmiot spełnia określone wymagania ( nie mylić z wzorcowaniem)
Walidacja – jest to weryfikacja ale określone wymagania są adekwatne do zamierzonego zastosowania
Wymagania ogólne
Bezstronność:
Norma ISO 17025 mówi, że działalność laboratoryjna prowadzona jest w sposób bezstronny. Zarządzanie i organizacja są podporządkowane także zapewnieniu bezstronności.
Kierownictwo działając na rzecz bezstronności jest odpowiedzialne również aby cała działalność laboratoryjna jej odpowiadała, w tym opierając się jakiejkolwiek presji finansowej czy naciskom komercyjnym.
Laboratorium ma za zadanie identyfikować ryzyka w odniesieniu do swojej bezstronności, wynikające na przykład od strony personelu czy samej działalności i powiązań.
Jeśli ryzyko zagrożenia bezstronności zostało zidentyfikowane to laboratorium powinno wskazać w jaki sposób je zminimalizuje bądź zlikwiduje.
Poufność
Poprzez prawnie wiążące zobowiązania laboratorium powinno być odpowiedzialne za zarządzanie informacjami związanymi z przedmiotem badania, w tym tymi otrzymanymi jak i wytworzonymi. Laboratorium powinno informować zawsze z wyprzedzeniem swojego klienta jeśli chce opublikować informacje publicznie.
Jeżeli w jakikolwiek sposób np prawnie, laboratorium jest zobligowane do ujawnienia poufnej informacji, to osoba lub firma której to dotyczy powinna zostać niezwłocznie powiadomiona.
Informacje o kliencie pochodzące z innych źródeł niż on sam powinny być poufne, a dostawca informacji nie ujawniany.
Wszystkie podmioty współpracujące,a głównie personel powinny zachować poufność do każdej informacji uzyskanej czy wytworzonej.
Wymagania dotyczące struktury
Norma ISO 17025 jasno określa, że laboratorium powinno być podmiotem prawnym, lub częścią podmiotu prawnego, tak aby być w pełni prawnie odpowiedzialnym za działalność laboratoryjną. (Państwowe laboratorium jest uważane za podmiot prawny na podstawie swojego statusu państwowego)
Zidentyfikowane kierownictwo ponosi pełną odpowiedzialność. Dodatkowo zapewnia komunikowanie skuteczności systemu zarządzania, oraz spełnienie wymagań klienta. A także utrzymanie ciągłości i integralności systemu zarządzania podczas planowania i wdrażania zmian.
Cały zakres działalności laboratorium powinien być udokumentowany, tak aby spełnione były wymaganie jakie określa norma ISO 17025. Owy zakres powinien obowiązywać w całości za wyjątkiem działalności dostarczanej na bieżąco z zewnątrz.
Przestrzegania wymagań powinno obowiązywać we wszystkich stałych siedzibach laboratorium, siedzibach czasowych czy mobilnych, a także siedzibach klienta jak i poza stałymi siedzibami.
Laboratorium powinno mieć określoną strukturę organizacyjną i zarządzania. Jasno zdeklarowane uprawnienia personelu i udokumentowane procedury w stopniu niezbędnym do zapewnienia spójnej realizacji działalności laboratoryjnej i ważności wyników.
Personel laboratorium niezależnie od innych swoich obowiązków powinien także mieć uprawnienia i zasoby do wdrażania, utrzymywania i doskonalenia systemu zarządzania. Identyfikacji odstępstw od tego systemu lub od procedur,a także inicjowania działań zapobiegających takim odstępstwom. W efekcie personel powinien zapewnić skuteczność działalności laboratoryjnej.
Wymagania dotyczące zasobów
Laboratorium powinno mieć dostęp do personelu, pomieszczeń, wyposażenia, systemów i usług wsparcia potrzebnych do zarządzania i prowadzenia działalności laboratoryjnej.
Personel
Cały personel (wewnętrzny, zewnętrzny) powinien działać bezstronnie, być kompetentny i pracować zgodnie z systemem zarządzania laboratorium.
Laboratorium powinno posiadać personel o odpowiednich kompetencjach w stosunku do zadań za które jest odpowiedzialny, aż do oceny znaczenia odstępstw.
Kierownictwo powinno jasno zakomunikować personelowi jego obowiązki, uprawnienia i odpowiedzialność.
Laboratorium powinno posiadać procedury, dzięki którym może zachować zapisy odnośnie:
- określenia wymagań kompetencji
- wybór personelu
- szkolenia personelu
- nadzorowanie personelu
- upoważnienie personelu
- monitorowanie kompetencji personelu
Personel powinien posiadać upoważnienia przynajmniej do:
- opracowywania, modyfikacji, weryfikacji i walidacji metod
- analizy wyników, stwierdzenie zgodności lub jej brak, albo wydanie interpretacji i opinii
- autoryzacja, przegląd raportowanie
Pomieszczenia i warunki środowiskowe
Pomieszczenia i warunki środowiskowe nie powinny mieć negatywnego wpływu na ważność wyników.
Przykładowe czynniki mogące wpływać na ich ważność to:
- zanieczyszczenia mikrobiologiczne
- zapylenie
- zakłócenia elektromagnetyczne
- promieniowanie
- wilgotność
- zasilanie elektryczne
- temperatura
- hałas
- drgania
Wszystkie wymagania co do pomieszczeń i warunków środowiskowych powinny być udokumentowane. Norma ISO 17025 kładzie duży nacisk na zapisywanie.
Warunki środowiskowe powinny być starannie monitorowane, kontrolowane i rejestrowane zgodnie z odpowiednimi specyfikacjami, procedurami, metodami, albo gdy po prostu jakkolwiek wpływają na ważność wyników.
Środki nadzorowania które będą wdrożone, monitorowane i okresowo przeglądane powinny obejmować przynajmniej:
- dostęp do obszarów wpływających na działalność laboratoryjną i ich wykorzystanie
- zapobieganie – zakłóceniom, zanieczyszczeniu i niekorzystnym wpływom na działalność laboratoryjną.
- skutecznie oddzielać obszary o wzajemnie wykluczającej się działalności laboratoryjnej
Jeżeli laboratorium prowadzi działalność w pomieszczeniach czy miejscach będących poza jego kontrolą, musi zapewnić, aby wszystkie wymagania dotyczące pomieszczeń i warunków były spełnione.
Wyposażenie
Laboratorium powinno mieć dostęp do wszelkiego potrzebnego wyposażenia, które jest wymagane do prawidłowej pracy i które może mieć wpływ na wyniki, są to:
- urządzenia pomiarowe,
- oprogramowania, wzorce pomiarowe,
- materiały odniesienia,
- dane odniesienia,
- odczynniki,
- materiały eksploatacyjne lub przyrządy pomocnicze

Istnieje wiele nazw dla materiałów odniesienia i certyfikowanych materiałów odniesienia, w tym wzorce odniesienia, wzorce do wzorcowania, wzorcowe materiały odniesienia i materiały do kontroli jakości. ISO 17034 zawiera dodatkowe informacje dotyczące producentów materiałów odniesienia (RMP). RMP, którzy spełniają wymagania (ISO 17034, przykład) są uważani za kompetentnych. Materiały odniesienia od RMP spełniających wymagania ISO 17034 dostarczane są wraz z kartą informacyjną produktu/certyfikatem, które określają, spośród innych charakterystyk, jednorodność i stabilność określonych właściwości oraz, dla certyfikowanych materiałów odniesienia, określone właściwości z certyfikowanymi wartościami, związaną z nimi niepewnością pomiaru oraz spójnością pomiarową.
ISO Guide 33 zawiera wytyczne dotyczące wyboru i stosowania materiałów odniesienia. ISO Guide 80 zawiera wytyczne dotyczące produkcji wewnętrznych materiałów do kontroli jakości (przykładowa prezentacja).
Jeżeli laboratorium korzysta z wyposażenia niebędącego pod jego stałą kontrolą to musi zapewnić, aby wszystkie wymagania były spełnione.
Aby zapewnić właściwe funkcjonowanie, zabezpieczenie przed zanieczyszczeniem, lub przed pogorszeniem stanu, laboratorium musi posiadać procedurę określającą sposoby postępowania, transportowania, konserwacji, użytkowania i przechowywania wyposażenia.
Zanim wyposażenie zostanie oddane do użytkowania, lub przywrócone, laboratorium powinno zweryfikować czy wyposażenie spełnia określone wymagania.
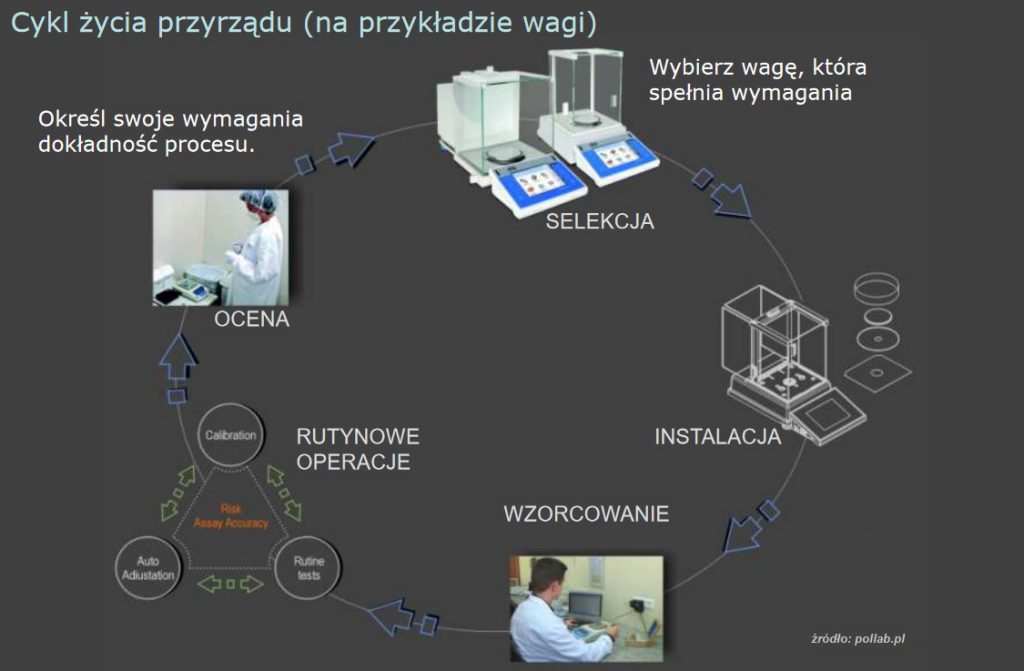
W przypadku wyposażenia do pomiarów, musi ono zapewniać wymaganą dokładność pomiaru i/lub niepewność pomiaru niezbędną do uzyskania ważnego wyniku.
Wzorcowanie wyposażenia pomiarowego odbywa się gdy:
- dokładność lub niepewność pomiaru wpływa na ważność raportowanych wyników
- wzorcowanie wyposażenia jest wymagane do ustanowienia spójności pomiarowej raportowanych wyników.
DO ZAPAMIĘTANIA: Rodzaje wyposażenia mającego wpływ na ważność raportowanych wyników, mogą obejmować:
- wyposażenie pomiarowe stosowane bezpośrednio do pomiaru wielkości mierzonej, np. stosowanie wagi do wykonania pomiaru masy;
- wyposażenie pomiarowe stosowane w celu wprowadzania poprawek do wyniku pomiaru wielkości mierzonej, np. pomiary temperatury;
- wyposażenie pomiarowe stosowane w celu uzyskania wyniku pomiaru obliczonego z wielu wielkości.
Laboratorium musi posiadać program wzorcowania, tak aby utrzymać prawidłowość wyników i statusu wzorcowania. Musi być on przeglądany i w razie konieczności dostosowywany.
Każde wyposażenie wymagające wzorcowania, lub mające określony okres przydatności do stosowania musi być odpowiednio oznaczone. To znaczy etykietowane, oznaczenie kodowe, albo zidentyfikowane tak aby użytkownik wyposażenia mógł w łatwy sposób zidentyfikować okres przydatności, albo zidentyfikować status wzorcowania.
Z wyposażeniem z którym postępowano niewłaściwie, lub zostało przeciążone, w efekcie czego daje wątpliwe wyniki, stwierdzono wadliwość lub wskazano przekroczenie wyspecyfikowanych wymagań, powinno być wycofane z eksploatacji. Następnie powinno być wyizolowane, aby zabezpieczyć przed użytkownikiem, lub etykietowane/oznaczone jako nieprzydatne do użytkowania, dopóki nie zostanie zweryfikowane poprawnie. Laboratorium następnie powinno zbadać wpływ wykrytej wady/odstępstwa od wyspecyfikowanych wymagań i zainicjować procedurę zarządzania pracą niezgodną z wymaganiami.
Jeżeli do utrzymania zaufania do działania wyposażenia konieczne są sprawdzenia pośrednie, należy je przeprowadzać zgodnie z procedurą.
Jeżeli dane dotyczące wzorcowania lub materiału odniesienia zawierają wartości odniesienia lub poprawki, laboratorium powinno zapewnić, aby wartości odniesienia oraz poprawki były aktualizowane i wdrażane.
Laboratorium powinno stosować praktyczne środki zapobiegające niezamierzonym adiustacjom (rozstrojeniom) wyposażenia mogącym spowodować utratę ważności wyników.
Zapisy dotyczące wyposażenia mogącego mieć wpływ na działalność laboratoryjną powinny być przechowywane. Zapisy te powinny obejmować, gdy ma to zastosowanie:
- identyfikację wyposażenia, włączając wersję oprogramowania i oprogramowania systemowego;
- nazwę producenta, oznaczenie typu oraz numer seryjny lub inne indywidualne oznaczenie;
- dowód weryfikacji, że wyposażenie jest zgodne z wyspecyfikowanymi wymaganiami;
- aktualną lokalizację;
- daty wzorcowania, wyniki wzorcowania, regulacje, kryteria przyjęcia oraz stosowną datę kolejnego wzorcowania albo odstęp pomiędzy wzorcowaniami;
- dokumentację materiałów odniesienia, wyniki, kryteria przyjęcia, właściwe daty i okres przydatności;
- plan konserwacji oraz konserwacje wykonane dotychczas, gdy jest to istotne dla działania wyposażenia;
- szczegóły dotyczące każdego uszkodzenia, wadliwego działania, modyfikacji lub naprawy wyposażenia.
Spójność pomiarowa
Laboratorium musi ustanowić i utrzymywać spójność pomiarową wyników pomiarów poprzez starannie dokumentowany, nieprzerwany ciąg wzorcowań, z których każde wnosi swój udział do niepewności pomiaru, wiążąc wyniki pomiarów z właściwym odniesieniem.
W ISO/IEC Guide 99 spójność pomiarowa jest zdefiniowana jako „właściwość wyniku pomiaru, przy której wynik może być związany z odniesieniem poprzez udokumentowany, nieprzerwany łańcuch wzorcowań, z których każde wnosi swój udział do niepewności pomiaru”.
Na koniec artykułu omówimy jeszcze w jednym module, dokładniej informacje dotyczące spójności pomiarowej.
Laboratorium powinno zapewnić, aby wyniki pomiarów były powiązane z SI, czyli Międzynarodowym Układem Jednostek Miar poprzez jedno z trzech:
- a) wzorcowanie przeprowadzone przez kompetentne laboratorium (według PN-EN ISO 17025 laboratoria spełniające wymagania tego dokumentu są kompetentne) ,
- b) certyfikowane wartości certyfikowanych materiałów odniesienia o wykazanej spójności pomiarowej z SI dostarczanych przez kompetentnego producenta (producenci materiałów odniesienia, którzy spełniają wymagania ISO 17034 są uznawani za kompetentnych.)
- c) bezpośrednią realizację jednostek miary SI potwierdzoną przez porównanie, bezpośrednie lub pośrednie, z państwowymi lub międzynarodowymi wzorcami ( Szczegóły praktycznej realizacji definicji niektórych istotnych jednostek miar podane są w broszurze SI).
Poniżej video z BIPM (organizacja międzyrządowa, za pośrednictwem której państwa członkowskie działają wspólnie w sprawach związanych z naukami pomiarowymi i standardami pomiarowymi).
Z kolei, jeśli spójność pomiarowa z jednostkami SI nie jest technicznie możliwa, laboratorium powinno wykazać spójność pomiarową z właściwym odniesieniem, np.
a) poprzez certyfikowane wartości certyfikowanych materiałów odniesienia dostarczanych przez kompetentnego producenta;
b) wyniki referencyjnych procedur pomiarowych, uzgodnionych wzorców czy określonych metod, które są szczegółowo opisane i zaakceptowane jako dostarczające wyniki pomiarów przydatne do ich zamierzonego zastosowania i które są potwierdzone właściwym porównaniem
Wyroby i usługi dostarczane z zewnątrz
Laboratorium w przypadku dostarczanych z zewnątrz wyrobów i usług wpływających na działalność laboratoryjną jest zobligowane do wykorzystywania wyłącznie takich gdy te wyroby i usługi:
- są przeznaczone do stosowania we własnej działalności laboratoryjnej;
- są dostarczane przez laboratorium bezpośrednio do klienta, w części lub całości, tak jak otrzymano od zewnętrznego dostawcy;
- są stosowane w celu wspierania czynności laboratorium.
UWAGA Wyroby mogą obejmować, na przykład, wzorce pomiarowe i wyposażenie, wyposażenie pomocnicze, materiały eksploatacyjne i materiały odniesienia.
Usługi mogą obejmować, na przykład, usługi wzorcowania, usługi pobierania próbek,
usługi badań, usługi utrzymania pomieszczeń i wyposażenia, usługi badań biegłości oraz usługi oceny i auditowania.
Laboratorium powinno mieć stworzoną procedurę i zachowywać zapisy dotyczące:
- określania, przeglądu i zatwierdzania wymagań laboratorium dla dostarczanych z zewnątrz wyrobów i usług;
- określania kryteriów oceny, wyboru, monitorowania wykonania i ponownej oceny zewnętrznych dostawców;
- zapewnienia, aby dostarczane z zewnątrz wyroby i usługi spełniały ustalone przez laboratorium wymagania, lub jeśli ma to zastosowanie, odpowiednie wymagania niniejszego dokumentu, zanim zostaną one użyte lub bezpośrednio dostarczone klientowi;
- podejmowania wszelkich działań wynikających z oceny, monitorowania wykonania i ponownej oceny zewnętrznych dostawców.
Laboratorium powinno jasno komunikować zewnętrznym dostawcom swoje wymagania (aby uniknąć niedomówień) dotyczące:
a) wyrobów i usług, które mają być dostarczone;
b) kryteriów akceptacji;
c) kompetencji, w tym wszelkich wymaganych kwalifikacji personelu;
d) czynności, które laboratorium lub jego klient zamierza przeprowadzić w siedzibie zewnętrznego dostawcy.
Wymagania dotyczące procesu
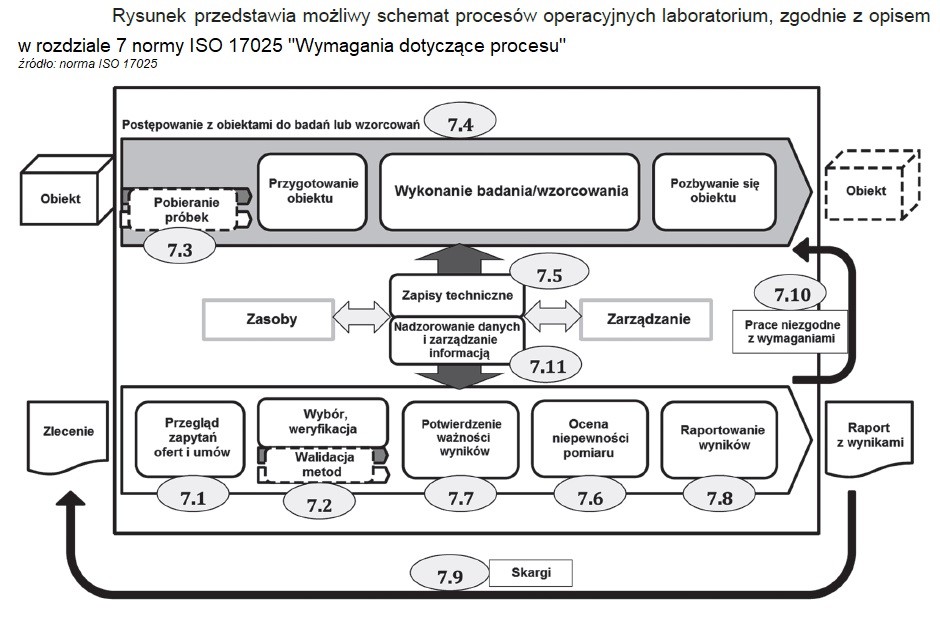
Przegląd zapytań, ofert i umów
Procedura dotycząca przeglądu powinna zapewniać by:
- wymagania były odpowiednio określone, udokumentowane i zrozumiałe
- laboratorium posiadało zasoby i możliwość, aby spełnić te wymagania
- w przypadku korzystania z zewnętrznych dostawców stosuje się przepisy wymienione wyżej, z paragrafu „Wyroby i usługi dostarczane z zewnątrz”
- wybrano właściwe metody lub procedury, zdolne spełnić wymagania klienta.
Sprostowanie:
W przypadku klientów wewnętrznych lub stałych, przegląd zapytań, ofert i umów może być przeprowadzony w sposób uproszczony.
Określone jest, że działalność laboratoryjna dostarczana z zewnątrz może zachodzić kiedy laboratorium nie posiada zasobów ani kompetencji do wykonywania działalności, ale również kiedy posiada te zasoby lub kompetencje, jednak ze względu na nieprzewidziane przyczyny nie jest ich w stanie podjąć samemu.
Jeśli jako laboratorium uznamy, że metoda badania proponowana przez klienta jest niewłaściwa, lub nieaktualna to musimy go niezwłocznie o tym powiadomić.
Gdy klient wymaga stwierdzenia zgodności (dodatkowe wytyczne ISO/IEC Guide 98-4) ze specyfikacją lub wymaganiem dotyczącym badania lub wzorcowania (np. spełnia/nie spełnia, w granicach tolerancji/poza granicami tolerancji), specyfikacja lub wymaganie oraz zasada podejmowania decyzji powinny być jasno określone. Jeżeli nie jest to zawarte w specyfikacji lub wymaganiu, wybrana zasada podejmowania decyzji powinna być zakomunikowana klientowi i z nim uzgodniona.
Norma ISO 17025 jasno wskazuje, że wszelkie wątpliwości, czy niedopowiedzenia pomiędzy zapytaniem lub ofertą, a umową powinny być wyjaśnione przed rozpoczęciem działalności laboratoryjnej. Każda umowa musi być zaakceptowana zarówno przez laboratorium, jaki klienta. W przeciwnym razie narażamy się na konsekwencje, rozbieżność oczekiwań i niezadowolenie. Odstępstwa wymagane przez klienta nie powinny wpływać na rzetelność laboratorium ani na ważność wyników.
Klient powinien być informowany o wszystkich odstępstwach od umowy.
W przypadku zmiany umowy po rozpoczęciu jej realizacji, powinno się powtórzyć przegląd umowy, a wszystkie zmiany powinny być zakomunikowane całemu personelowi zaangażowanemu w realizację umowy.
Laboratorium powinno współpracować z klientami lub ich przedstawicielami w celu uściślenia ich oczekiwań oraz w celu monitorowania działań laboratorium związanych z realizowaną pracą.
Na czym ta współpraca ma polegać?
- Na zapewnieniu odpowiedniego dostępu do właściwych obszarów laboratorium w celu obserwacji specyficznych czynności działalności laboratoryjnej wykonywanej dla klienta.
- Na przygotowaniu, pakowaniu oraz wysyłce obiektów potrzebnych klientowi do celów weryfikacji.
Z przeglądów należy zachowywać zapisy, obejmujące również wszelkie istotne zmiany. Należy również zachowywać zapisy ze stosownych rozmów z klientem, dotyczących jego wymagań lub wyników działalności laboratoryjnej. Ogólnie polecam przyjąć tę strategię za pewnik, nie tylko w stosunku do kierownictwa laboratorium, ale również pomiędzy personelem a klientem.
Wybór, weryfikacja i walidacja metod
Wybór i weryfikacja
Wg PN-EN ISO/IEC 17025:2018-2 laboratorium powinno stosować właściwe procedury i metody dla całej działalności laboratoryjnej, oraz jeżeli jest to właściwe, do oceny niepewności pomiaru i technik statystycznych stosowanych do analizy danych (słowo metoda/metody w normie ISO 17025 może być używane jako synonim „procedura pomiarowa” z terminologii ISO).
Wszystkie metody, procedury i dokumentacja uzupełniająca jak instrukcje, normy, podręczniki i dane odniesienia, istotne dla działalności laboratoryjnej, powinny być stale aktualizowane oraz łatwo dostępne dla personelu. Nie fachowym jest sporządzenie dokumentów „dla siebie” i nieodpowiednia ich dystrybucja, co dodatkowo narusza postanowienia normy ISO 17025:2017.
Laboratorium powinno zapewnić stosowanie ostatniej ważnej wersji metody, chyba że jest to niewłaściwe lub niemożliwe. Kiedy jest to konieczne, stosowanie metody powinno być uzupełnione o dodatkowe szczegóły, aby zapewnić jej jednakowe stosowanie.
Pamiętaj, że normy międzynarodowe, regionalne lub krajowe, lub inne uznane specyfikacje, które zawierają wystarczające i pełne informacje umożliwiające przeprowadzenie działalności laboratoryjnej, nie wymagają uzupełniania ani przepisywania jako wewnętrzne procedury, jeżeli normy te są tak napisane, że mogą być stosowane przez personel w laboratorium.
Może okazać się jednak konieczne, że akty nie są dostatecznie zrozumiałe i konieczne będzie dostarczenie dodatkowej dokumentacji dotyczącej opcjonalnych kroków w metodzie lub dodatkowych szczegółów/przykładów/wyjaśnień.
Jeżeli klient nie określił metody, która ma być zastosowana, laboratorium powinno wybrać właściwą metodę i poinformować klienta o wybranej metodzie.
Rekomendowane są metody:
- opublikowane w normach: międzynarodowych, regionalnych lub krajowych, lub
- przez renomowane organizacje techniczne, lub
- opublikowane w odpowiednich tekstach lub czasopismach naukowych, bądź
- określone przez producenta wyposażenia.
- można też wykorzystywać metody opracowane lub zmodyfikowane przez laboratorium.
Laboratorium zawsze powinno zweryfikować, czy jest w stanie prawidłowo realizować metody przed ich wprowadzeniem, poprzez upewnienie się, że może osiągać wymagane rezultaty-parametry.
Zapisy z weryfikacji powinny być zachowywane. Jeśli metoda jest zmieniona przez wydawcę, weryfikację należy powtórzyć w niezbędnym zakresie.
Jeżeli wymagane jest opracowanie metody, powinno to być planowane zadanie, a jego realizacja powinna być powierzona personelowi posiadającemu odpowiednie kompetencje i zasoby.
Podczas opracowywania metody koniecznie trzeba przeprowadzać okresowe przeglądy, aby potwierdzić, że potrzeby klienta są nadal spełniane. Wszelkie modyfikacje planu powinny być zatwierdzane i autoryzowane.
Odnośnie działalności laboratoryjnej odstępstwa dopuszcza się tylko wówczas, gdy są one udokumentowane, technicznie uzasadnione, zatwierdzone oraz zaakceptowane przez klienta.
Przy czym odstępstwa ze strony klienta mogą być zaakceptowane wcześniej, na etapie zawierania umowy.
Walidacja metod
Szczególna ostrożność: Laboratorium powinno przeprowadzić walidację metod nieznormalizowanych, metod opracowanych przez laboratorium oraz metod znormalizowanych wykorzystywanych poza przewidzianym dla nich zakresem lub w inny sposób zmodyfikowanych.
Walidacja powinna być na tyle obszerna, na ile jest to konieczne, aby spełnić potrzeby danego zastosowania lub obszaru zastosowania.
Walidacja może obejmować procedury pobierania próbek, postępowania i transportu obiektów do badań lub wzorcowań, a techniki stosowane do walidacji metody mogą być jedną z niżej wymienionych albo ich mieszanką:
- wzorcowanie lub wyznaczanie systematycznego błędu pomiaru i precyzji z wykorzystaniem wzorców odniesienia lub materiałów odniesienia;
- systematyczna i ciągłe ocena czynników wpływających na wynik;
- badanie odporności metody poprzez zmianę kontrolowanych parametrów, takich jak temperatura inkubacji, odmierzona objętość;
- porównanie wyników uzyskanych innymi zwalidowanymi metodami;
- porównania międzylaboratoryjne;
- ocena niepewności wyników pomiarów oparta na wiedzy o zasadach teoretycznych metody i praktycznym doświadczeniu w realizacji metody pobierania próbek lub metody badania.
Jeżeli do zwalidowanej metody wprowadzane są zmiany, to należy określić ich oddziaływanie, a w przypadku gdy będą one miały wpływ na pierwotną walidację, należy przeprowadzić nową walidację metody.
Cechy zwalidowanych metod, ocenione patrząc na nie z puktu zamierzonego zastosowania, powinny być odpowiednie do potrzeb klienta i spójne z określonymi wymaganiami.
Cechy charakterystyczne mogą obejmować: zakres pomiarowy, dokładność, niepewność wyników pomiarów, granicę wykrywalności, granicę oznaczalności, selektywność metody, liniowość, powtarzalność lub odtwarzalność, odporność na czynniki zewnętrzne lub wrażliwość na zakłócenia pochodzące z matrycy próbki lub badanego obiektu oraz
systematyczny błąd pomiaru.
Laboratorium zawsze powinno zachowywać zapisy z walidacji dotyczące:
- a) zastosowanej procedury walidacji;
- b) specyfikacji wymagań;
- c) określania cech charakterystycznych metody;
- d) uzyskanych wyników;
- e) stwierdzenia walidacyjnego dotyczącego metody, wskazującego na jej przydatność do zamierzonego za stosowania.
Pobieranie próbek
Laboratorium musi mieć plan i metodę pobierania próbek, jeżeli pobiera próbki substancji, materiałów lub wyrobów, które są następnie badane lub wzorcowane. Metoda pobierania próbek powinna uwzględniać czynniki, które należy kontrolować, aby zapewnić ważność wyników dalszych badań lub wzorcowań.
Plan i metoda pobierania próbek powinny być zawsze dostępne w miejscu pobierania próbek. Tak aby nawet osoba będąca pierwszy dzień w pracy mogła je pobrać samodzielnie. Plany pobierania próbek powinny być (kiedy jest to uzasadnione), oparte na właściwych metodach statystycznych.
Metoda pobierania próbek powinna opisywać:
- a) wybór próbek lub miejsc;
- b) plan pobierania próbek;
- c) przygotowanie i postępowanie z próbką/próbkami odnośnie substancji/materiału/wyrobu w celu uzyskania wymaganego obiektu dla dalszych badań lub wzorcowań.
Laboratorium powinno zachowywać zapisy danych z pobierania próbek, które stanowią część przeprowadzonego badania lub wzorcowania. Zapisy powinny obejmować, gdy to istotne:
- odniesienie do zastosowanej metody pobierania próbek;
- datę i czas pobierania próbek;
- dane identyfikujące i opisujące próbkę (np. numer, ilość, nazwa);
- identyfikację personelu wykonującego pobieranie próbek;
- identyfikację użytego wyposażenia;
- warunki środowiskowe lub transportu;
- schematy lub inne równoważne środki służące do określenia miejsca pobierania próbek, kiedy jest to sto sowne;
- odstępstwa, uzupełnienia lub wyłączenia od metody pobierania próbek i planu pobierania próbek.
Postępowanie z obiektami do badań lub wzorcowań
Laboratorium musi posiadać procedury dotyczące transportowania, przyjmowania i postępowania z obiektami podlegającymi badaniu lub wzorcowaniu wraz z ich :
- zabezpieczaniem,
- przechowywaniem,
- przetrzymywaniem i pozbywaniem się lub zwracaniem,
zawierające także opis wszystkich warunków niezbędnych do ochrony integralności obiektu badania, lub wzorcowania oraz ochrony interesów laboratorium i klienta.
Powinny być podejmowane środki ostrożności, aby zapobiec
- pogorszeniu właściwości,
- zanieczyszczeniu,
- utracie lub uszkodzeniu
obiektu podczas postępowania, transportu, przechowywania/oczekiwania oraz przygotowywania do badania lub wzorcowania.
Powinno się postępować zgodnie z instrukcjami obsługi dostarczonymi wraz z obiektem.
Laboratorium powinno mieć system jednoznacznej identyfikacji badanych lub wzorcowanych obiektów.
Identyfikację tę należy zachowywać przez cały czas, gdy laboratorium ponosi odpowiedzialność za obiekt.
System powinien zapewniać, że obiekty nie będą pomylone ani fizycznie, ani w zapisach, ani w innych dokumentach. System powinien, jeżeli to właściwe, uwzględniać podział obiektu lub grupy obiektów oraz sposób przekazywania obiektów.
Po przyjęciu obiektu do badania lub wzorcowania, należy zapisywać odstępstwa od wyspecyfikowanych warunków.
W razie wątpliwości, czy obiekt nadaje się do badania lub wzorcowania, lub jeżeli obiekt nie jest zgodny z dostarczonym opisem, laboratorium powinno skonsultować z klientem dalsze postępowanie przed przystąpieniem do pracy i powinno zapisywać rezultaty ustaleń z klientem.
Jeżeli klient wymaga, aby obiekt został poddany badaniu lub wzorcowaniu, przyjmując odstępstwo od określonych warunków, laboratorium powinno umieścić zastrzeżenie w raporcie, wskazujące, na które wyniki może mieć wpływ dane odstępstwo.
Warunki środowiskowe powinny być zawsze utrzymywane, monitorowane i zapisywane, jeżeli tylko obiekty wymagają przechowywania lub kondycjonowania w tych (określonych) warunkach.
Zapisy techniczne
Zapisy techniczne dotyczące każdej działalności laboratoryjnej muszą zawierać wyniki, dane i dostateczne informacje umożliwiające (gdy jest to możliwe) identyfikację czynników wpływających na wynik pomiaru i związaną z nim niepewność pomiaru oraz umożliwiające powtórzenie działania laboratoryjnego w warunkach możliwie jak najbliższych tym, w jakich je wykonano pierwotnie.
Zapisy techniczne powinny zawierać datę oraz identyfikację personelu odpowiedzialnego za każdą działalność laboratoryjną oraz za sprawdzenie danych i wyników.
Pierwotne obserwacje, dane i obliczenia powinny być zapisywane w chwili ich wykonania i powinny być identyfikowalne z określonym zadaniem.
Laboratorium jest zobligowane do zapewnienia możliwośi śledzenia zmian w zapisach technicznych w odniesieniu do poprzednich wersji lub do pierwotnych obserwacji.
Należy zachowywać zarówno oryginalne, jak i zmienione dane i pliki, w tym datę zmiany, wskazanie zmienionych fragmentów oraz personelu odpowiedzialnego za zmiany.
Ocena niepewności pomiaru
Laboratorium powinno identyfikować składowe niepewności pomiaru. Przy ocenie niepewności po miaru należy wziąć pod uwagę wszystkie istotne składowe, w tym wynikające z pobierania próbek, stosując odpowiednie metody analizy.
Laboratorium zgodnie z ISO 17025 , które wykonuje wzorcowanie, w tym własnych urządzeń, powinno oceniać niepewność pomiaru dla wszystkich wzorcowań.
Laboratorium, które wykonuje badania, powinno oceniać niepewność pomiaru. W przypadku gdy metoda badawcza wyklucza ścisłą ocenę niepewności pomiaru, szacowanie powinno być oparte na wiedzy o zasadach teoretycznych lub praktycznym doświadczeniu w realizacji metody.
W przypadkach, w których powszechnie uznana metoda badań podaje wartości graniczne dla wartości głównych źródeł niepewności pomiaru i podaje sposób przedstawienia obliczonych wyników, uznaje się, że laboratorium spełnia wymagania, gdy postępuje zgodnie z metodą badań i instrukcjami dotyczącymi przedstawiania wyników.
W przypadku gdy niepewność pomiaru wyników została ustanowiona i zweryfikowana dla konkretnej jednej metody, nie jest konieczna ocena niepewności pomiaru dla każdego uzyskiwanego wyniku przy zastosowaniu tej metody, jeżeli laboratorium może wykazać, że czynniki zidentyfikowane krytyczne wpływające na wynik są kontrolowane.
Więcej informacji:
- ISO/IEC Guide 98-3,
- ISO 21748
- norma wieloczęściowa ISO 5725.
Potwierdzenie ważności wyników
Laboratorium powinno mieć procedurę monitorowania ważności wyników.
Uzyskiwane dane powinny być zapisywane w taki sposób, aby możliwe było śledzenie kierunków ich zmian oraz, jeżeli to możliwe, powinny być stosowane techniki statystyczne w celu przeglądu wyników. Monitorowanie powinno być planowane i poddawane przeglądom, i powinno obejmować, jeżeli to odpowiednie:
- a) korzystanie z materiałów odniesienia lub materiałów do kontroli jakości;
- b) korzystanie z alternatywnego wyposażenia, które zostało poddane wzorcowaniu w celu zapewnienia spójności pomiarowej wyników;
- c) sprawdzenie działania wyposażenia pomiarowego i badawczego;
- d) stosowanie wzorców kontrolnych lub roboczych z kartami kontrolnymi, gdy ma to zastosowanie;
- e) sprawdzenia pośrednie wyposażenia pomiarowego;
- f) powtarzanie badań lub wzorcowań z wykorzystaniem tych samych lub innych metod;
- g) powtórne badanie lub wzorcowanie przechowywanych obiektów;
- h) korelację wyników dotyczących różnych właściwości obiektu;
- i) przegląd uzyskanych wyników;
- j) porównania wewnątrzlaboratoryjne;
- k) badanie próbki ślepej.
Laboratorium monitoruje swoje działania poprzez porównanie z wynikami innych laboratoriów, jeżeli są one dostępne i właściwe. Monitorowanie powinno być planowane i poddawane przeglądom i powinno obejmować jedną lub obie z poniższych czynności:
a) uczestnictwo w badaniach biegłości;
ISO/IEC 17043 zawiera dodatkowe informacje dotyczące badań biegłości i organizatorów badań biegłości. Natomist organizatorzy badań biegłości spełniający wymagania ISO/IEC 17043 są uznawani za kompetentnych.
b) uczestnictwo w porównaniach międzylaboratoryjnych innych niż badania biegłości.
Dane z monitorowania powinny być analizowane, wykorzystywane do kontroli oraz, jeśli ma to zastosowanie, do doskonalenia działalności laboratoryjnej. Jeżeli w wyniku analizy danych z monitorowania zostanie stwierdzone przekroczenie wcześniej określonych kryteriów, należy podjąć odpowiednie działania, aby zapobiec umieszczaniu nieprawidłowych wyników w raporcie.
Raportowanie wyników
Norma ISO 17025 informuje, że wyniki powinny być przeglądane i autoryzowane przed wydaniem.
Ponadto powinny być przedstawiane dokładnie, jasno, jednoznacznie i obiektywnie, zwykle w raporcie (np. w sprawozdaniu z badań lub świadectwie wzorcowania lub sprawozdaniu z pobierania próbek), i powinny zawierać wszystkie informacje uzgodnione z klientem i niezbędne do interpretacji wyników oraz wszystkie informacje wymagane w zastosowanej metodzie. Wszystkie wydane raporty powinny być zachowywane jako zapisy techniczne.
Do celów normy ISO 17025 sprawozdania z badań i świadectwa wzorcowania są czasami nazywane, zamiennie jako, świadectwami z badań i sprawozdaniami z wzorcowania.
Raporty mogą być wydawane jako wersje papierowe lub elektroniczne, pod warunkiem że spełnione zostaną wymagania normy ISO 17025.
Jeżeli zostało to uzgodnione z klientem, wyniki mogą być przedstawiane w sposób uproszczony. Każda informacja wymieniona w omawianej normie ISO 17025 w działach:
- Wspólne wymagania dotyczące raportów (sprawozdań z badań, świadectw wzorcowania lub sprawozdań z pobierania próbek)
- Wymagania szczególne dotyczące sprawozdań z badań
- Wymagania szczególne dotyczące świadectw wzorcowania
- Raportowanie pobierania próbek – wymagania szczególne
- Przedstawianie stwierdzeń zgodności
która nie jest przedstawiana klientowi, powinna być łatwo dostępna.
Wspólne wymagania dotyczące raportów (sprawozdań z badań, świadectw wzorcowania lub sprawozdań z pobierania próbek)
Każdy raport powinien zawierać co najmniej niżej podane informacje, chyba że laboratorium ma ważne powody, aby tego nie robić, minimalizując przy tym jakąkolwiek możliwość niezrozumienia lub niewłaściwego użycia:
- tytuł (np. „Sprawozdanie z badań” lub „Świadectwo wzorcowania” lub „Sprawozdanie z pobierania próbek”);
- nazwę i adres laboratorium;
- miejsce wykonania działalności laboratoryjnej, w tym, gdy jest ona realizowana w siedzibie klienta lub w miejscach innych niż stałe siedziby laboratorium lub w powiązanych tymczasowych lub ruchomych siedzibach laboratorium;
- jednoznaczną identyfikację zapewniającą, że wszystkie jego elementy są uznawane za część kompletnego raportu, oraz jednoznaczną identyfikację końca;
- nazwę i dane kontaktowe klienta;
- identyfikację zastosowanej metody;
- opis, jednoznaczną identyfikację i, jeżeli to konieczne, stan obiektu;
- datę przyjęcia obiektu(-ów) do badania lub wzorcowania i datę pobrania próbki, gdy jest to istotne dla ważności wyników i ich zastosowania;
- datę(-y) wykonania działalności laboratoryjnej;
- datę wydania raportu;
- odwołanie się do planu pobierania próbek i zastosowanej przez laboratorium lub inne organizacje metody pobierania próbek, gdy jest to istotne dla ważności wyników i ich zastosowania;
- stwierdzenie, że wyniki dotyczą wyłącznie obiektów badanych, wzorcowanych lub poddanych pobieraniu próbek;
- wyniki wraz z, tam gdzie to właściwe, jednostkami miary;
- uzupełnienia, odstępstwa lub ograniczenia metody;
- identyfikację osoby (osób) autoryzującej(-ych) raport;
- wyraźną identyfikację wyników dostarczanych przez zewnętrznych dostawców.
Bardzo przydatne jest dodanie stwierdzenia, że raport bez zgody laboratorium nie powinien być powielany inaczej niż w całości, może stanowić gwarancję, że części raportu nie będą wykorzystywane oddzielnie od kontekstu.
Laboratorium powinno ponosić odpowiedzialność za wszystkie informacje przedstawiane w raporcie, poza informacjami dostarczonymi przez klienta. Dane dostarczane przez klienta powinny być jednoznacznie zidentyfikowane. Dodatkowe zastrzeżenie powinno być przedstawione w raporcie, gdy informacje są dostarczone przez klienta i mogą wpływać na ważność wyników. W przypadku gdy laboratorium nie ponosi odpowiedzialności za etap pobierania próbek (np. próbka została dostarczona przez klienta), w raporcie należy zamieścić stwierdzenie, że wyniki odnoszą się do otrzymanej próbki.
Wymagania szczególne dotyczące sprawozdań z badań
Oprócz wymagań podanych wcześniej, sprawozdania z badań powinny zawierać, jeżeli to niezbędne do interpretacji wyników, następujące dane:
a) informacje o specyficznych warunkach badania, takich jak warunki środowiskowe;
b) jeżeli to istotne, stwierdzenie zgodności z wymaganiami lub specyfikacjami;
c) jeżeli ma to zastosowanie, niepewność pomiaru przedstawioną w tych samych jednostkach miary co wielkość mierzona lub jako odniesienie do wielkości mierzonej (np. procent), kiedy:
- jest to istotne dla ważności lub zastosowania wyników badań;
- jest to uzgodnione z klientem;
- niepewność pomiaru wpływa na zgodność z wyspecyfikowaną granicą;
d) jeżeli to właściwe, opinie i interpretacje
e) dodatkowe informacje, które mogą być wymagane w określonych metodach, przez organy regulacyjne, klientów lub grupy klientów.
Gdy laboratorium jest odpowiedzialne za pobieranie próbek, sprawozdania z badań powinny spełniać wymagania podane w dziale „Raportowanie pobierania próbek – wymagania szczególne„, gdy jest to konieczne do interpretacji wyników badań.
Wymagania szczególne dotyczące świadectw wzorcowania
Oprócz wymagań podanych we wspólnych wymaganiach dotyczących raportów, świadectwa wzorcowania powinny zawierać:
a) niepewność wyniku pomiaru przedstawioną w tych samych jednostkach miary co wielkość mierzona lub jako odniesienie do wielkości mierzonej (np. procent);
„Zgodnie z ISO/IEC Guide 99, wynik pomiaru jest zwykle wyrażany za pomocą pojedynczej wartości wielkości zmierzonej wraz z jednostką miary i niepewnością pomiaru”
b) warunki (np. środowiskowe), w których wykonano wzorcowanie i które mają wpływ na wyniki pomiarów;
c) stwierdzenie, jak zapewniono spójność pomiarową wyników pomiarów ;
d) wyniki przed i po każdej adiustacji lub naprawie, jeżeli są dostępne;
e) jeżeli to istotne, stwierdzenie o zgodności z wymaganiami lub specyfikacjami (patrz dział „Przedstawienie stwierdzeń zgodności”);
f) jeżeli to właściwe, opinie i interpretacje („Przedstawianie opinii i interpretacji”).
Gdy laboratorium jest odpowiedzialne za pobieranie próbek, świadectwa wzorcowania powinny spełniać wymagania podane w „Raportowanie pobierania próbek – wymagania szczególne”, gdy jest to konieczne do interpretacji wyników wzorcowania.
Świadectwo wzorcowania lub etykieta wzorcowania nie powinny zawierać jakichkolwiek zaleceń dotyczących czasu ponownego wzorcowania, z wyjątkiem sytuacji, kiedy uzgodniono to z klientem.
Raportowanie pobierania próbek – wymagania szczególne
Gdy laboratorium jest odpowiedzialne za pobieranie próbek, oprócz wymagań podanych w „Wspólne wymagania dotyczące raportów”, jeżeli to konieczne do interpretacji wyników, raporty powinny zawierać:
- a) datę pobierania próbek;
- b) jednoznaczną identyfikację przedmiotu lub materiału podlegającego pobieraniu (w tym nazwę producenta, oznaczenie modelu lub typu i numery seryjne, jeżeli jest to właściwe);
- c) miejsce pobierania próbek, w tym wszystkie schematy, szkice oraz fotografie;
- d) odniesienie do planu pobierania próbek i metody pobierania;
- e) szczegóły dotyczące warunków środowiskowych podczas pobierania próbek, które mają wpływ na interpretację wyników;
- f) informacje wymagane do oceny niepewności pomiaru późniejszych badań lub wzorcowań.
Przedstawianie stwierdzeń zgodności
Gdy przedstawiane jest stwierdzenie zgodności ze specyfikacją lub wymaganiem, laboratorium po winno udokumentować przyjętą zasadę podejmowania decyzji, biorąc pod uwagę poziom ryzyka związanego z przyjętą zasadą (takiego jak błędna akceptacja i błędne odrzucenie oraz założenia statystyczne) i zastosować zasadę podejmowania decyzji.
Gdy zasada podejmowania decyzji jest określona przez klienta, przepisy lub dokumenty normatywne, dalsze rozpatrywanie poziomu ryzyka nie jest konieczne.
Laboratorium powinno przedstawić stwierdzenie zgodności w taki sposób, aby stwierdzenie jasno identyfikowało:
- a) do których wyników odnosi się stwierdzenie zgodności;
- b) które specyfikacje, normy lub ich części są spełnione, a które nie;
- c) zastosowaną zasadę podejmowania decyzji (o ile nie jest ona właściwie określona we wskazanej specyfikacji lub normie).
*Dodatkowe informacje, patrz ISO/IEC Guide 98-4.
Przedstawianie opinii i interpretacji
Gdy są przedstawiane opinie i interpretacje, laboratorium powinno zapewnić, aby tylko personel upoważniony do wyrażania opinii i interpretacji wydawał odpowiednie oświadczenia. Laboratorium powinno udokumentować podstawy wydawania opinii i interpretacji. Ważne jest, aby odróżniać opinie i interpretacje od stwierdzeń w inspekcji i certyfikacji wyrobów, tak jak jest to przewidziane w ISO/IEC 17020 i ISO/IEC 17065 oraz od stwierdzeń zgodności, jak wskazano w dziale „Przedstawianie stwierdzeń zgodności”
Opinie i interpretacje przedstawiane w raportach powinny opierać się o uzyskane wyniki badań lub wzorcowań i powinny być jednoznacznie zidentyfikowane jako takie.
Gdy opinie i interpretacje są bezpośrednio przekazywane w rozmowie z klientem, zapisy z rozmów powinny być zachowywane.
Zmiany do raportów
Gdy wydany raport wymaga zmiany, poprawy lub ponownego wydania, każda zmiana informacji po winna być wyraźnie zidentyfikowana oraz, jeżeli to właściwe, w raporcie powinna być podana przyczyna zmiany.
Zmiany do już wydanego raportu powinny być wprowadzane tylko w formie dodatkowego dokumentu lub przekazu danych zawierającego stwierdzenie „Zmiana do raportu, numer kolejny …. [lub zidentyfikowanego w inny sposób]”, lub inne równoważne sformułowanie.
Takie zmiany powinny spełniać wszystkie wymagania ISO 17025.
Gdy konieczne jest wydanie całkowicie nowego raportu, powinien być on jednoznacznie zidentyfikowany i powinien zawierać odniesienie do pierwotnego dokumentu, który zastępuje.
Skargi
Laboratorium powinno posiadać udokumentowany proces przyjmowania, oceny i podejmowania decyzji w sprawie skarg.
Opis procesu postępowania ze skargami powinien być dostępny na życzenie dla wszystkich stron zainteresowanych. Po otrzymaniu skargi laboratorium powinno potwierdzić, czy skarga odnosi się do działalności laboratoryjnej, za którą jest odpowiedzialne, a jeżeli tak, to powinno ją rozpatrzyć. Laboratorium powinno ponosić odpowiedzialność za wszystkie decyzje, na wszystkich poziomach procesu postępowania ze skargami.
Proces postępowania ze skargami powinien obejmować co najmniej następujące elementy i metody:
- a) opis procesu przyjmowania, potwierdzania, rozpatrywania skargi oraz decydowania o tym, jakie działania zostaną podjęte w odpowiedzi na nią;
- b) śledzenie i zapisywanie skarg, w tym działań podjętych w celu ich rozpatrzenia;
- c) zapewnienie podejmowania wszelkich stosownych działań.
Laboratorium otrzymując skargę, powinno być odpowiedzialne za zebranie i zweryfikowanie wszystkich niezbędnych informacji w celu potwierdzenia zasadności skargi.
Jeżeli to możliwe, laboratorium powinno potwierdzić przyjęcie skargi i dostarczyć składającemu skargę sprawozdania z przebiegu jej rozpatrywania oraz jego rezultat.
Rezultaty, które mają być przekazane składającemu skargę powinny być opracowane lub sprawdzone i zatwierdzone przez osobę(-y) niezaangażowaną(-e) w działalność laboratoryjną, której skarga dotyczy (może to być realizowane przez zewnętrzny personel).
Jeżeli to możliwe, laboratorium powinno formalnie powiadomić składającego skargę o zakończeniu rozpatrywania skargi.
Prace niezgodne z wymaganiami
Laboratorium powinno mieć procedurę, która powinna być stosowana wówczas, gdy jakikolwiek aspekt jego działalności laboratoryjnej, lub wynik tej pracy, nie jest zgodny z jego własnymi procedurami, lub wymaganiami uzgodnionymi z klientem (np. wyposażenie lub warunki środowiskowe nie spełniają określonych granic, wyniki monitorowania nie spełniają określonych kryteriów). Procedura powinna zapewnić, aby:
a) ustalono odpowiedzialność i uprawnienia dotyczące zarządzania pracą niezgodną z wymaganiami;
b) były podejmowane działania (łącznie z zatrzymaniem lub powtórzeniem pracy i wycofaniem raportów, jeżeli to konieczne) bazujące na ustalonym przez laboratorium poziomie ryzyka;
c) dokonywano oceny znaczenia pracy niezgodnej, łącznie z analizą jej wpływu na wcześniejsze wyniki;
d) podejmowano decyzje dotyczące możliwości przyjęcia pracy niezgodnej z wymaganiami;
e) kiedy to konieczne, klient jest powiadamiany, a praca jest wycofana;
f) ustalono odpowiedzialność za wyrażenie zgody na wznowienie pracy.
Laboratorium powinno zachowywać zapisy związane z pracą niezgodną z wymaganiami i podejmować działania wymienione wyżej.
Jeżeli ocena wskazuje, że praca niezgodna z wymaganiami mogłaby się powtórzyć lub jeżeli istnieje wątpliwość co do zgodności działań laboratorium z własnym systemem zarządzania, laboratorium powinno wdrożyć działania korygujące.
Nadzorowanie danych i zarządzanie informacją
Laboratorium powinno mieć dostęp do danych i informacji potrzebnych do prowadzenia działalności laboratoryjnej.
Laboratoryjny system zarządzania informacją wykorzystywany do gromadzenia, przetwarzania, zapisywania, raportowania, przechowywania lub odzyskiwania danych, należy przed wdrożeniem walidować (sprawdzać każdą funkcję) w laboratorium pod kątem funkcjonalności, łącznie z poprawnością funkcjonowania interfejsów wewnątrz laboratoryjnego systemu (bądź kilku) zarządzania informacją.
Wszystkie zmiany, łącznie z konfiguracją oprogramowania laboratorium lub modyfikacjami oprogramowania komercyjnego, powinny być autoryzowane, udokumentowane i zwalidowane przed ich wdrożeniem.
Gotowe oprogramowanie komercyjne wykorzystywane zgodnie z przewidzianym dla niego zakresem stosowania, uważa się za dostatecznie zwalidowane.
Laboratoryjny system(laboratoryjne systemy) zarządzania informacją powinien/powinny:
a) być chroniony(-e) przed nieupoważnionym dostępem;
b) być zabezpieczony(-e) przed naruszeniem lub utratą;
c) działać w środowisku zgodnym ze specyfikacjami dostawcy lub laboratorium lub, w przypadku systemów nieskomputeryzowanych, zapewniać warunki gwarantujące dokładność zapisów odręcznych i transkrypcję;
d) być utrzymywany(-e) w sposób zapewniający integralność danych i informacji;
e) uwzględniać awarie systemu rejestracji i odpowiednie korekcje oraz działania korygujące.
Jeżeli laboratoryjny system zarządzania informacją jest zarządzany i utrzymywany z zewnątrz lub przez zewnętrznego dostawcę, laboratorium powinno zapewnić, aby dostawca lub operator systemu spełniał mające zastosowania wymagania normy ISO 17025.
Laboratorium powinno zapewnić, aby instrukcje, podręczniki i dane odniesienia związane z laboratoryjnym(-i) systemem(-ami) zarządzania informacją były łatwo dostępne dla personelu.
Obliczenia i przenoszenie danych powinny być właściwie i systematycznie sprawdzane.
Wymagania dotyczące systemu zarządzania
Postanowienia ogólne i możliwe opcje
Laboratorium powinno udokumentować, ustanowić, wdrożyć i utrzymywać system zarządzania, który umożliwia dokładne wspieranie i wykazywanie stałego spełniania niezbędnych wymagań w tym omawianej normy ISO 17025 i zapewnienia jakości wyników
laboratorium.
Dodatkowo, spełniając wymagania poprzednich rozdziałów (od 4 do 7, czyli wymagania ogólne, wymagania dotyczące struktury, wymagania dotyczące zasobów, wymagania dotyczące procesu) laboratorium powinno wdrożyć system zarządzania zgodnie z Opcją A lub Opcją B, które omówimy poniżej.
Opcja A
System zarządzania laboratorium powinien obejmować co najmniej:
- dokumentację systemu zarządzania
- nadzór nad dokumentami systemu zarządzania
- nadzór nad zapisami
- działania dotyczące ryzyk oraz szans
- doskonalenie
- działania korygujące
- audity wewnętrzne
- przeglądy zarządzania
Opcja B
Laboratorium, które ustanowiło i utrzymuje system zarządzania zgodnie z wymaganiami ISO 9001 i jest w stanie wspierać i wykazać stałe spełnienie wymagań Rozdziałów od 4 do 7 (jeszcze raz dla przypomnienia: czyli wymagania ogólne, wymagania dotyczące struktury, wymagania dotyczące zasobów, wymagania dotyczące procesu) , spełnia także wymagania systemu zarządzania opisane dalej.
Dokumentacja systemu zarządzania -Opcja A
Kierownictwo laboratorium ustanawia, dokumentuje i utrzymuje polityki i cele dotyczące spełnienia wymagań omawianego dokumentu ISO 17025, a także musi zapewnić, aby polityki i cele były znane i wdrożone na wszystkich poziomach organizacyjnych laboratorium.
Polityki i cele dotyczą między innymi:kompetencji, bezstronności i spójności działania laboratorium.
Kierownictwo laboratorium powinno dostarczyć dowody zaangażowania w opracowanie i wdrożenie systemu zarządzania oraz ciągłe doskonalenie jego skuteczności.
Całość dokumentacji, procesy, systemy, zapisy, odnoszące się do spełnienia wymagań ISO 17025, powinny być włączone do systemu zarządzania, odwoływać się do niego lub być powiązane z tym systemem.
Personel zaangażowany w działalność laboratoryjną powinien mieć dostęp do tej części dokumentacji systemu zarządzania i związanych z nią informacji, odnoszących się do jego odpowiedzialności.
Nadzór nad dokumentami systemu zarządzania (Opcja A)
Laboratorium powinno regularnie nadzorować dokumenty (zarówno wewnętrzne jak i zewnętrzne), które odnoszą się do spełnienia wymagań niniejszego dokumentu.
Jako dokumenty określa się np. polityki, procedury, specyfikacje, instrukcje producenta, tabele wzorcowania, wykresy, podręczniki, plakaty, notatki, wykazy, rysunki, plany itp. Mogą one występować na różnych nośnikach, takich jak papierowy lub elektroniczny.
Laboratorium powinno zapewnić, aby:
- przed wydaniem dokumenty były zawsze zatwierdzane pod kątem ich adekwatności przez upoważniony personel;
- dokumenty były okresowo przeglądane i jeżeli to konieczne aktualizowane,
- zmiany i aktualny status zmian dokumentów były zidentyfikowane;
- odpowiednie wersje mających zastosowanie dokumentów były dostępne w miejscach ich stosowania i jeżeli jest to konieczne, było nadzorowane ich rozpowszechnianie;
- dokumenty były jednoznacznie zidentyfikowane;
- trzeba zapobiegać nieświadomemu stosowaniu nieaktualnych dokumentów i odpowiednio je oznaczać, jeżeli są zachowywane z jakichkolwiek powodów.
Nadzór nad zapisami (Opcja A)
Laboratorium powinno ustanowić i zachowywać czytelne zapisy w celu wykazania spełnienia wymagań normy ISO 17025.
Laboratorium powinno wdrożyć nadzór potrzebny do identyfikacji, przechowywania, ochrony, tworzenia kopii zapasowych, archiwizowania, wyszukiwania, ustalania czasu zachowywania (polecam jak najdłużej) i usuwania zapisów. Laboratorium powinno zachowywać zapisy przez okres zgodny z jego zobowiązaniami wynikającymi z umów. Dostęp do tych zapisów powinien być zgodny z zasadami poufności, a zapisy powinny być łatwo dostępne.
Działania odnoszące się do ryzyk i szans (Opcja A)
Laboratorium powinno rozpatrywać ryzyka oraz szanse związane z działalnością laboratoryjną w celu:
a) zapewnienia, aby system zarządzania osiągał zamierzone wyniki;
b) zwiększenia możliwości osiągania zamierzeń i celów laboratorium;
c) zapobieżenia wystąpieniu niepożądanych skutków działalności laboratoryjnej i potencjalnych błędów w tej działalności lub ich ograniczenia;
d) osiągnięcia doskonalenia.
Laboratorium powinno planować:
1. Działania odnoszące się do ryzyk i szans;
2. Sposób:
- integrowania i wdrażania tych działań w swoim systemie zarządzania;
- oceny skuteczności tych działań.
Pomimo wskazania w normie PN-EN ISO 17025:2019-2 że laboratorium planuje działania odnoszące się do ryzyk, nie ma wymagania dotyczącego formalnych metod zarządzania ryzykiem lub udokumentowanego procesu zarządzania ryzykiem. Laboratoria mogą zdecydować, czy opracować szerszą metodykę zarządzania ryzykiem niż wymaga tego niniejszy dokument, np. stosując inny przewodnik lub normy.
Działania podejmowane w odniesieniu do ryzyk i szans powinny być proporcjonalne do ich potencjalnego wpływu na ważność wyników laboratorium.
Opcjonalnie działania odnoszące się do ryzyk mogą obejmować identyfikowanie i unikanie zagrożeń, podejmowanie ryzyka w celu wykorzystania szansy, eliminowanie źródła ryzyka, zmianę prawdopodobieństwa lub następstw, dzielenie się ryzykiem lub zatrzymanie ryzyka na podstawie świadomej decyzji.
Szanse mogą prowadzić do rozszerzenia działalności laboratoryjnej, pozyskania nowych klientów, stosowania nowych technologii i innych możliwości uwzględniających potrzeby klientów.
Doskonalenie (Opcja A)
Laboratorium powinno identyfikować i wybierać możliwości doskonalenia oraz wdrażać wszelkie nie zbędne działania.
Możliwości doskonalenia mogą być zidentyfikowane poprzez przegląd procedur operacyjnych, stosowanie polityk, ogólne cele, wyniki auditów, działania korygujące, przegląd zarządzania, zgłoszenia personelu, ocenę ryzyka, analizę danych oraz wyniki badań biegłości.
Laboratorium powinno dążyć do pozyskiwania od swoich klientów informacji zwrotnych, zarówno pozytywnych, jak i negatywnych. Informacje zwrotne powinny być analizowane i wykorzystywane do doskonalenia systemu zarządzania, działalności laboratoryjnej oraz obsługi klienta.
Przykłady rodzajów informacji zwrotnych obejmują ankiety dotyczące zadowolenia klienta, zapisy z kontaktów, przeglądy raportów z klientami.
Działania korygujące (Opcja A)
Gdy wystąpi niezgodność, laboratorium powinno:
a) zareagować na niezgodność i, jeżeli ma to zastosowanie:
- podjąć działania w celu jej nadzorowania i skorygowania;
- zająć się konsekwencjami niezgodności;
b) ocenić potrzebę działań eliminujących przyczynę (przyczyny) niezgodności, w celu uniknięcia jej ponownego wystąpienia lub wystąpienia w innym miejscu, poprzez:
- przegląd i analizę niezgodności;
- ustalenie przyczyn niezgodności;
- ustalenie, czy podobne niezgodności występują lub mogłyby wystąpić;
c) wdrożyć potrzebne działania;
d) dokonać przeglądu skuteczności wszystkich podjętych działań korygujących;
e) aktualizować ryzyka i szanse określone podczas planowania, jeżeli to konieczne;
f) wprowadzić zmiany w systemie zarządzania, jeżeli to konieczne.
Działania korygujące powinny być dostosowane do skutków stwierdzonych niezgodności.
Laboratorium powinno zachowywać zapisy jako dowód:
a) charakteru niezgodności, przyczyny (przyczyn) i podjętych w następstwie działań;
b) wyników wszystkich działań korygujących.
Audity wewnętrzne (Opcja A)
Laboratoria powinny przeprowadzać audity wewnętrzne w starannie zaplanowanych odstępach czasu w celu dostarczenia informacji, czy system zarządzania:
a) jest zgodny z:
- wymaganiami własnymi laboratorium dotyczącymi systemu zarządzania, w tym działalności laboratoryjnej;
- wymaganiami niniejszego dokumentu;
b) jest skutecznie wdrożony i utrzymywany.
Laboratorium powinno:
a) zaplanować, ustanowić, wdrożyć i utrzymywać program auditów obejmujący:
- częstość auditów,
- metody, odpowiedzialność,
- wymagania dotyczące planowania i raportowania, który powinien uwzględniać znaczenie danej działalności laboratoryjnej,
- zmiany wpływające na laboratorium oraz wyniki poprzednich auditów;
b) określić kryteria auditu i zakres dla każdego auditu;
c) zapewnić, aby wyniki auditów były przedstawiane właściwemu kierownictwu;
d) wdrożyć bez nieuzasadnionej zwłoki odpowiednie korekcje i działania korygujące;
e) zachowywać zapisy stanowiące dowód wdrożenia programu auditu oraz wyniki auditu.
ISO 19011 dostarcza wytycznych dotyczących auditów wewnętrznych
Przeglądy zarządzania (Opcja A)
Kierownictwo laboratorium powinno w zaplanowanych odstępach czasu przeprowadzać przegląd systemu zarządzania, aby zapewnić jego stałą przydatność, adekwatność i skuteczność, łącznie z ustalonymi politykami i celami odnoszącymi się do spełnienia wymagań niniejszego dokumentu.
Dane wejściowe do przeglądu zarządzania powinny być zapisywane i powinny odnosić się do:
- zmian czynników wewnętrznych i zewnętrznych, które są istotne dla laboratorium;
- realizacji celów;
- przydatności polityk i procedur;
- statusu działań podjętych w następstwie wcześniejszych przeglądów zarządzania;
- wyników ostatnich auditów wewnętrznych;
- działań korygujących;
- ocen przeprowadzanych przez podmioty zewnętrzne;
- zmian w zakresie i rodzaju prac lub w zakresie działalności laboratoryjnej;
- informacji zwrotnych od klientów i personelu;
- skarg;
- skuteczności wszelkich wdrożonych doskonaleń;
- adekwatności zasobów;
- wyników identyfikacji ryzyka;
- rezultatów potwierdzenia ważności wyników; oraz
- innych istotnych czynników, takich jak monitorowanie działalności i szkolenia.
Dane wyjściowe z przeglądu zarządzania powinny dokumentować wszystkie decyzje i działania odnoszące się co najmniej do:
a) skuteczności systemu zarządzania i jego procesów;
b) doskonalenia działalności laboratoryjnej dotyczącej spełnienia wymagań niniejszego dokumentu;
c) zapewnienia wymaganych zasobów;
d) każdej potrzebnej zmiany.
Spójność pomiarowa- rozwinięcie
Spójność pomiarowa jest ustanowiona poprzez uwzględnienie, a następnie zapewnienie:
- a) opisu wielkości mierzonej (wielkości, która ma być zmierzona);
- b) udokumentowanego, nieprzerwanego łańcucha wzorcowań powiązanego z ustanowionymi i właściwymi odniesieniami (właściwe odniesienia obejmują wzorce państwowe i międzynarodowe oraz wzorce wewnętrzne);
- c) aby niepewność pomiaru dla każdego etapu łańcucha spójności pomiarowej była oceniana według uzgodnionych metod;
- d) aby każdy etap łańcucha realizowany był zgodnie z odpowiednimi metodami, z podaniem wyników pomiarów oraz z powiązanymi, udokumentowanymi niepewnościami pomiarów;
- e) aby laboratoria realizujące jeden lub więcej etapów w łańcuchu dostarczały dowodu swoich kompetencji technicznych.
Systematyczny błąd pomiaru (czasami nazywany obciążeniem) wzorcowanego wyposażenia jest uwzględniany przy zapewnieniu spójności pomiarowej wyników pomiarów w laboratorium. Dostępnych jest szereg sposobów uwzględniania systematycznych błędów pomiarów przy zapewnieniu spójności pomiarowej.
Wzorce pomiarowe, dla których kompetentne laboratorium przedstawiło w raporcie informację zawierającą wyłącznie stwierdzenie zgodności ze specyfikacją (z pominięciem wyników pomiarów i związanych niepewności), są czasami wykorzystywane przy zapewnieniu spójności pomiarowej.
Podejście to, w którym granice specyfikacji są wprowadzone jako źródła niepewności, zależy od:
- zastosowania właściwej zasady podejmowania decyzji przy stwierdzeniu zgodności;
- granic specyfikacji, które następnie są uwzględnione w odpowiedni technicznie sposób w budżecie nie pewności.
Podstawą techniczną takiego podejścia jest to, że deklarowana zgodność ze specyfikacją określa zakres wartości mierzonych, w którym oczekuje się wartości prawdziwej, przy określonym poziomie ufności, który uwzględnia zarówno błąd systematyczny, jak również niepewność pomiaru.
Wykazanie spójności pomiarowej
Laboratoria są odpowiedzialne za ustanowienie spójności pomiarowej zgodnie z wymaganiami niniejszego dokumentu.
Wyniki wzorcowania z laboratoriów działających zgodnie z niniejszym dokumentem zapewniają spójność pomiarową. Certyfikowane wartości certyfikowanych materiałów odniesienia pochodzących od producentów materiałów odniesienia spełniających wymagania ISO 17034 zapewniają spójność pomiarową.
Istnieje szereg sposobów wykazania zgodności z niniejszym dokumentem: uznanie trzeciej strony (takiej jak jednostka akredytująca), zewnętrzna ocena przez klientów lub samoocena.
Uznane w skali międzynarodowej sposoby obejmują między innymi:
- Wzorcowania i zdolności pomiarowe realizowane przez krajowe instytuty metrologiczne i instytuty desygnowane, które zostały poddane odpowiednim procesom ocen równorzędnych. Taka ocena wzajemna jest przeprowadzana w ramach CIPM MRA (International Committee for Weights and Measures Mutual Recognition Arrangement). Usługi objęte CIPM MRA można znaleźć w Załączniku C do BIPM KCDB (International Bureau of Weights and Measures Key Comparison Database), w którym przedstawiono zakres i niepewność pomiarów dla wszystkich wyszczególnionych usług.
- Wzorcowania i zdolności pomiarowe, które zostały akredytowane przez jednostkę akredytującą będącą sygnatariuszem porozumienia ILAC (International Laboratory Accreditation Cooperation) lub porozumień regionalnych uznanych przez ILAC, posiadają wykazaną spójność pomiarową. Zakresy akredytacji laboratoriów są powszechnie udostępniane przez właściwe jednostki akredytujące.
Wspólna deklaracja BIPM, OIML (International Organization of Legal Metrology), ILAC i ISO dotycząca spójności pomiarowej dostarcza szczegółowych wytycznych, gdy istnieje potrzeba wykazania międzynarodowego uznania dla łańcucha spójności pomiarowej.
Opcje systemu zarządzania- rozwinięcie
Wzrost zastosowania systemów zarządzania ogólnie zwiększył potrzebę zapewnienia, że laboratoria mogą działać w systemie zarządzania, który jest postrzegany jako zgodny z ISO 9001 i jednocześnie z niniejszym dokumentem. W rezultacie dokument ten przedstawia dwie opcje dla wymagań związanych z wdrożeniem systemu zarządzania.
REKLAMA
Koniecznie zobacz NAJLEPSZE szkolenie z Facebooka na rynku

Link do kursu: szkolenie Facebook Ads
Koniec reklamy.
Opcja A
Wskazuje minimalne wymagania dotyczące wdrożenia systemu zarządzania w laboratorium. Zwrócono uwagę na uwzględnienie tych wszystkich wymagań ISO 9001, które mają powiązanie z zakresem działalności laboratoryjnej objętym systemem zarządzania. Laboratoria, które spełniają wymagania rozdziałów normy ISO 17025 od 4 do 7 i wdrożyły opcję A wymagań Rozdziału 8 (również normy ISO 17025) będą również ogólnie działać zgodnie z zasadami ISO 9001.
Opcja B
Pozwala laboratoriom ustanowić i utrzymywać system zarządzania zgodnie z wymaganiami ISO 9001 w sposób, który wspiera i wykazuje spełnienie wymagań rozdziałów od 4 do 7. Laboratoria, które wdrożyły opcję B wymagań Rozdziału 8 będą również działać zgodnie z ISO 9001.
Zgodność systemu zarządzania, w ramach którego działa laboratorium, z wymaganiami ISO 9001 nie oznacza samo w sobie wykazania kompetencji laboratorium do dostarczania ważnych danych i wyników. To jest osiągane poprzez spełnienie wymagań Rozdziałów od 4 do 7.
Celem obu opcji jest osiągnięcie takiego samego wyniku funkcjonowania systemu zarządzania oraz zgodność z wymaganiami rozdziałów od 4 do 7.
Jeśli ktoś posiada tekst normy to:
Dokumenty, dane i zapisy są elementami udokumentowanej informacji, tak jak jest to stosowane w ISO 9001 i innych normach dotyczących systemów zarządzania. Nadzór nad dokumentami jest objęty 8.3. Nadzór nad zapisami jest objęty 8.4 i 7.5. Nadzór nad danymi odnoszącymi się do działalności laboratoryjnej jest objęty 7.11.
Jakie dokumenty i zapisy są wymagane?
Poniżej znajdziesz dokumenty i zapisy wymagane dla optymalnego funkcjonowania Twojego systemu zarządzania, aby spełnić ogólne wymagania ISO 17025: 2017. Dokumenty są generowane w celu wykazania zgodności ze standardowymi i powiązanymi procedurami wewnętrznymi oraz służą jako dowód podczas audytów.
Obowiązkowe Dokumenty ISO 17025
| Dokument | Punkt normy ISO 17025: 2017 |
| Procedura kontroli dokumentów i zapisów | 8.2.1; 8.3; 8.4; 7.5 |
| Polityki i cele jakości | 8.2.; 8.2.2 |
| Procedura dotycząca kompetencji, wyboru, nadzorowania i szkolenia pracowników | 6.2.5 |
| Procedura dotycząca produktów i usług dostarczanych z zewnątrz | 6.6.2 |
| Procedura dotycząca infrastruktury i warunków środowiskowych | 6.3 |
| Procedura dotycząca sprzętu i kalibracji-spójność pomiarowa | 6.4.3; 6.5 |
| Procedura obsługi klienta | 7.1.1; 8.6 |
| Wybór i procedura walidacji | 7.2.1; 7.2.2 |
| Procedura zapewnienia jakości wyników | 7.7.1; 7.7.2; 7.7.3 |
| Procedura pobierania próbek | 7.3; 7.5 i 7.8.5, dotyczy tylko laboratoriów pobierających próbki |
| Postępowanie z przedmiotami otrzymanymi do procedury badań i wzorcowań | 7.4 |
| Procedura reklamacji, niezgodności i działań korygujących | 7.9; 7.10; 8.7 |
| Procedura raportu z badań | 7.8.2; 7.8.3, dotyczy laboratoriów badawczych, które sporządzają raporty z badań |
| Raport z kalibracji i procedura świadectw wzorcowania | 7.8.2; 7.8.4, dotyczy laboratoriów wzorcujących, które sporządzają świadectwa wzorcowania |
| Cele dotyczące jakości | 8.2.1 |
| Program szkoleniowy | 6.2.3 |
| Rejestr odbytych szkoleń i wymaganych kompetencji | 6.2.2 |
| Rejestr obecności | 6.2.2 |
| Dokument zatwierdzenia i autoryzacji kompetencji | 5.6; 6.2.5 e |
| Dokumentacja oceny i zatwierdzenia dostawcy | 6.6.2 a |
| Lista zatwierdzonych dostawców produktów i usług | 6.6.2 a |
| Zapis laboratoryjnych kontroli warunków środowiskowych | 6.3.3 |
| Lista sprzętu laboratoryjnego | 6.4.13 a |
| Zapis wzorcowanego sprzętu | 6.4.13 a |
| Zapis wzorcowania | 6.4.13 e |
| Dokumentacja konserwacji sprzętu | 6.4.13 g |
| Przegląd rozmów z klientem | 7.1.8 |
| Raport zadowolenia klienta | 8.6.2 |
| Badanie metod, weryfikacja i walidacja- rejestrowanie | 7.2.1.2 |
| Badanie metod, weryfikacja i walidacja- zapisy | 7.2.2.4; 7.6.3 |
| Zapis niepewności pomiaru | 7.6.3 |
| Wewnętrzna rejestracja kontroli jakości i badania biegłości/ILC | 7.7.2; 7.7.3 |
| Rejestr walidacyjny LIMS | 7.11 |
| Zapis walidacji LIMS | 7.11 |
| Plan pobierania próbek | 7.3.1 |
| Raport z pobierania próbek | 7.3.3 |
| Dziennik rejestracji badanych lub wzorowanych obiektów | 7.4 |
| Raport działań naprawczych | 8.7.3 |
| Zapisy: Dziennik skarg, niezgodności i działań naprawczych | 8.7.3 |
| Lista dokumentów wewnętrznych i zewnętrznych | 8.2.4; 8.3.1 |
| Lista rodzajów rejestrów | 8.4 |
| Rejestr akt do przechowywania / archiwum centralne | 8.3.2 f; 8.4.1 |
| Program audytu wewnętrznego | 8.8.2 b |
| Raport z audytu wewnętrznego | 8.8.2 e |
| Zapisy z przeglądu zarządzania | 8.9.2 |
W jaki sposób norma ISO 17025 wpływa na międzynarodowe uznawanie wyników badań i wzorcowań przeprowadzanych przez laboratoria?
Norma ISO 17025 przez określenie międzynarodowo uzgodnionych standardów dla kompetencji laboratoriów badawczych i wzorcujących ułatwia międzynarodowe uznawanie wyników badań. Laboratoria spełniające te wymagania mogą być akredytowane przez narodowe jednostki akredytacyjne, co zwiększa zaufanie do ich wyników na arenie międzynarodowej.
Jakie są główne wyzwania związane z wdrożeniem i utrzymaniem zgodności z normą ISO 17025 w laboratorium?
Wyzwania związane z wdrożeniem i utrzymaniem zgodności z normą ISO 17025 mogą obejmować potrzebę ciągłego szkolenia personelu, zapewnienia odpowiednich warunków lokalowych i środowiskowych, zarządzania dokumentacją oraz monitorowania i utrzymania sprzętu laboratoryjnego. Dodatkowo, laboratoria muszą regularnie poddawać się zewnętrznym auditom akredytacyjnym, co wymaga utrzymania wysokiego poziomu jakości pracy na co dzień.
Czy norma ISO 17025 odnosi się wyłącznie do laboratoriów naukowych, czy może być stosowana również w innych typach laboratoriów, np. w przemyśle?
Norma ISO 17025 jest stosowana nie tylko w laboratoriach naukowych, ale także w szerokim zakresie innych laboratoriów, w tym tych działających w przemyśle, medycynie, ochronie środowiska i innych. Jej uniwersalność i elastyczność sprawiają, że może być ona adaptowana do różnych specyfik działalności laboratoryjnej, zapewniając jednocześnie wysoki standard zarządzania jakością i kompetencji technicznych.
Powszechnie używane nieobowiązkowe dokumenty
Aby doskonalić swoje laboratorium, powinieneś również przechowywać wszelkie inne dokumenty i zapisy, które określiłeś jako niezbędne, aby zapewnić efektywne utrzymanie systemu zarządzania i jego ulepszanie w miarę upływu czasu.
Istnieje kilka procesów i procedur, które należy ustalić, jednak norma ISO 17025 nie wymaga ich spisania. Mimo to, w celu generowania i przechowywania odpowiednich zapisów stanowiących dowód skutecznego wdrożenia, wiele firm decyduje się to zrobić. Aby zdecydować, czy musisz udokumentować proces, najpierw odpowiedz na to pytanie – czy istnieje szansa, że proces nie zostanie przeprowadzony zgodnie z planem, jeśli nie zostanie udokumentowany? Jeśli odpowiedź brzmi „tak”, najlepiej ją udokumentować. W większości przypadków jest to najlepszy sposób na zapewnienie skutecznego wdrożenia Systemu Zarządzania Jakością. Zobaczmy więc listę często używanych nieobowiązkowych dokumentów ISO 17025.
Nieobowiązkowe Dokumenty ISO 17025
| Dokument | Punkt normy ISO 17025: 2017 |
| Procedura dotycząca ryzyka i szans | 8.5.2; 8.5.3 |
| Procedura oceny niepewności pomiaru | 7.6 |
| Lista kontrolna niepewności pomiaru | 7.6.1 |
| Lista kontrolna procesu audytu wewnętrznego | 8.8.1 |
| Procedura audytu wewnętrznego | 8.8.2 |
| Procedura przeglądu zarządzania | 8.9 |
| Rejestr kluczowych ryzyk i szans | 8.5.2 |
Szkolenie ISO 17025, szkolenie dla laboratoriów i szkolenie na auditora wewnętrznego ISO 17025:2017
Zamów poniżej dla siebie, swojego laboratorium lub pracowników
+48 790-768-482
info@rafalszrajnert.pl
Norma ISO 17025 to znakomity system na pracę w laboratorium ze wszystkimi standardami. Zapewniając najlepsze wyniki dla naszej placówki jak i dla klienta. A Ty co myślisz o jej stosowaniu? Zostaw swoją opinię w komentarzu na dole.


Co myślisz o moim nowym wpisie na blogu?
A może masz pytanie dotyczące strategii lub techniki jak działać najlepiej?
Tak czy inaczej, chciałbym usłyszeć, co masz do powiedzenia.
Więc śmiało, teraz udostępnij ten wpis na swoich social mediach i zobacz co inni mają do powiedzenia.


![Podejście procesowe w zarządzaniu. Główny element Systemu Zarządzania [przedsiębiorstwo i organizacja] 16 podejście procesowe](https://www.rafalszrajnert.pl/wp-content/uploads/2020/02/PODEJSCIE-PROCESOWE-960x750.jpg)


